A RAVICTI® biztonságossága és tolerálhatósága1,2
A RAVICTI® (glicerin-fenilbutirát) átfogóan dokumentálva van a karbamidciklus idült zavarainak kezelése terén.
A RAVICTI® mellékhatások felmérése CPS, OTC, ASS, ASL, ARG vagy HHH hiányban szenvedő, 114 UCD beteg (65 felnőtt, 49 gyermek: 2 hónapos és 17 éves életkor között) klinikai vizsgálatban végzett expozícióján alapult. A további mellékhatásokat egy klinikai vizsgálatban értékelték, amelybe 16, 2 hónaposnál fiatalabb, UCD-ben szenvedő gyermeket vontak be.
A klinikai vizsgálatok során leggyakrabban jelentett mellékhatások (a betegbetegek legalább 10%-a):
- Felnőtt betegbetegek: hasmenés, haspuffadás, fejfájás, hányinger, hányás, csökkent étvágy, szédülés és fáradtság
- Gyermekkorú betegbetegek (2 – 17 év): felhasi fájdalom, kiütés, hányinger, hányás, hasmenés, csökkent étvágy és fejfájás
- Gyermekkorú betegek (2 hónap – < 2 év) neutropénia, hányás, székrekedés, hasmenés, láz, hypophagia, köhögés, orrdugulás, orrfolyás, kiütések és papulák
- Gyermekkorú betegek (< 2 hónap) hányás, kiütés, gastroesophagealis reflux, emelkedett májenzimszint, táplálkozási rendellenesség (csökkent étvágy, hypophagia), anaemia, köhögés, dehidratáció, metabolikus acidózis, trombocitózis, neutropénia, limfocitózis, hasmenés, haspuffadás, székrekedés, láz, levertség és irritábilitás/nyugtalanság
Kezeléssel összefüggő káros mellékhatások esetén – RAVICTI kontra NaPBA
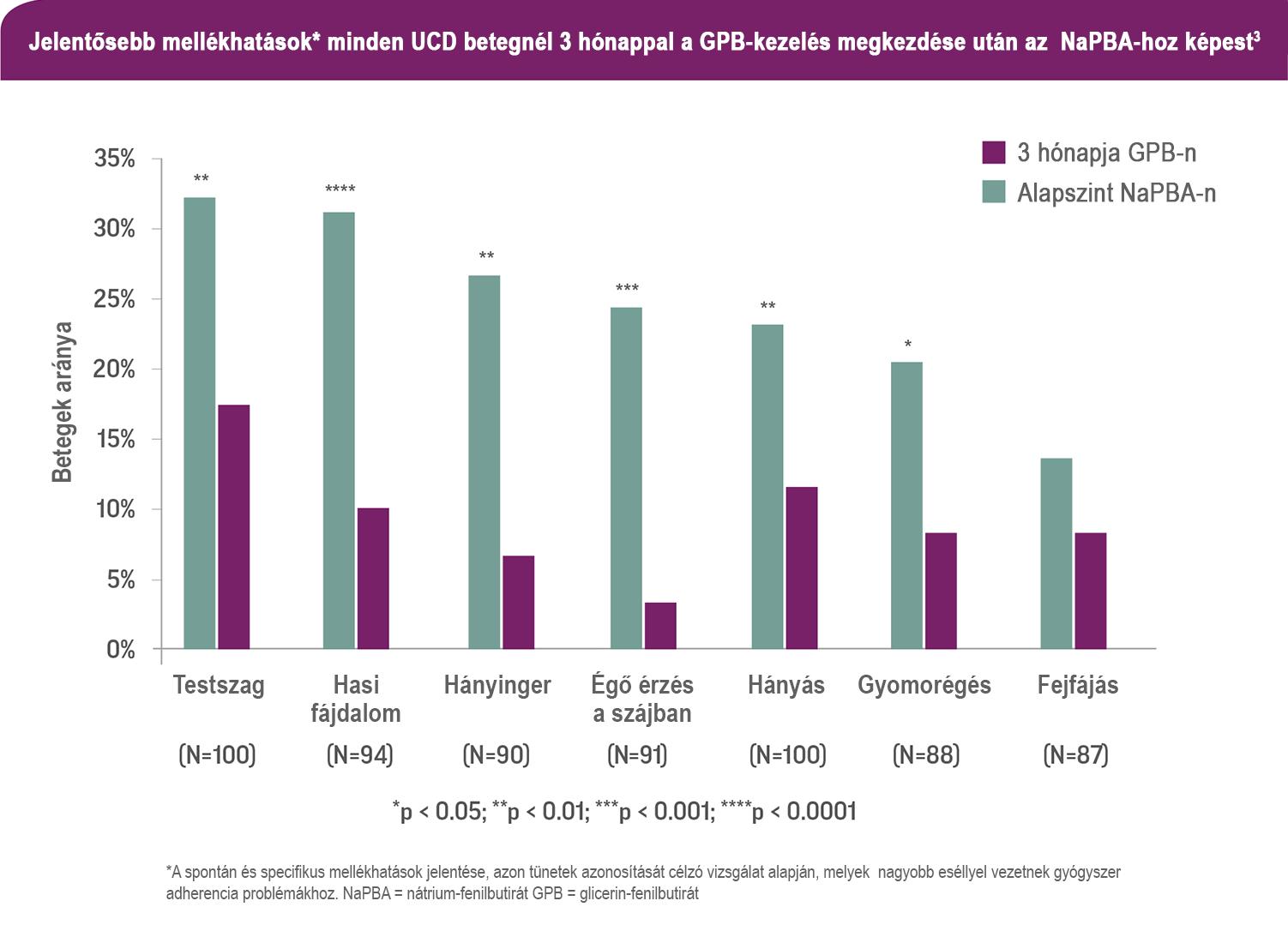
Száz beteg vagy azok gondviselői reagáltak egy nem hitelesített, UCD-specifikus kérdőívre, amely tartalmazta az ammónia-megkötőkhöz gyakran társított tünetek előre meghatározott listáját is. Az alapértékeket (amíg a betegek nátrium-fenilbutirátot [NaPBA] kaptak) összehasonlították a három hónapos glicerin-fenilbutirát (GPB) kezelést követő értékekkel.3
Különleges figyelmeztetések és az alkalmazással kapcsolatos óvintézkedések
A heveny hyperammoniaemia, a hyperammonaemiás encephalopathiát is ideértve, még a glicerin-fenilbutiráttal kezelt betegek egy kis részénél is előfordulhat.
- Hatóanyaggal szembeni túlérzékenység
- Heveny hyperammonaemia kezelése
Az exokrin hasnyálmirigy enzimek hidrolizálják a glicerin-fenilbutirátot a vékonybélben, leválasztva az aktív részt, a fenilbutirátot a glicerintől. Ez a folyamat lehetővé teszi, hogy a fenilbutirát felszívódjon a keringésbe. A hasnyálmirigy enzimek kis mennyisége vagy hiánya, vagy zsírfelszívódási zavart okozó bélbetegség miatt glicerin-fenilbutirát csökkent mértékben vagy egyáltalán nem emésztődik meg, és/vagy a fenilbutirát csökkent mértékben vagy egyáltalán nem szívódik fel, és a plazma ammóniaszint kontrollálhatósága csökken. Az ammóniaszinteket monitorozni kell hasnyálmirigy-elégtelenségben vagy felszívódási zavarban szenvedő betegeknél.
Neurotoxicitásra utaló reverzibilis klinikai tüneteket (pl. hányinger, hányás, aluszékonyság) jelentettek 499–1285 µg/ml közötti fenilacetát szintekkel összefüggésben olyan rákos betegeknél, akik intravénásan kaptak PAA-t. Bár ilyen szinteket UCD betegekkel végzett klinikai vizsgálatokban nem figyeltek meg, magas PAA szintre lehet gyanakodni olyan betegeknél (főleg a 2 hónaposnál fiatalabb gyermekeknél), akiknél megmagyarázhatatlan aluszékonyság, zavartság, hányinger és levertség fordul elő, normál vagy alacsony ammóniaszint mellett.
Ha magas ammóniaszint vagy egyéb interkurrens betegségek hiányában hányás, hányinger, fejfájás, aluszékonyság, zavartság vagy álmosság tünetei fordulnak elő, akkor meg kell mérni a plazma PAA szintet és plazma PAA/PAGN arányát, és meg kell fontolni a glicerin-fenilbutirát adag csökkentését vagy az adagolás gyakoriságának növelését, ha a PAA szintje nagyobb, mint 500 µg/l és a plazma PAA/PAGN arány nagyobb, mint 2,5.
A napi dózist egyénileg kell beállítani a beteg becsült karbamid-szintézis kapacitása, ha van ilyen, aminosav profilja, fehérjetoleranciája és a növekedés és fejlődés elősegítéséhez szükséges napi fehérjebevitele függvényében. Aminosav kiegészítő készítményekre lehet szükség az esszenciális aminosavak és az elágazó láncú aminosavak normál tartományban tartásához. A további beállítás a plazma ammónia, a glutamin, az U-PAGN és/vagy a plazma PAA és PAGN, valamint a plazma PAA/PAGN arányának ellenőrzésére alapozható (lásd 4.2 pont).
Kortikoszteroidok
A kortikoszteroidok használata miatt lebomolhatnak a test fehérjéi, ami növelheti a plazma ammónia szintjét. Kortikoszteroidok és glicerin-fenilbutirát együttes alkalmazása esetén szigorúan felügyelje az ammóniaszintet.
Valproinsav és haloperidol
Hyperammonaemiát okozhat a haloperidol és a valproinsav. Ha az UCD-s betegeknek valproinsavra vagy haloperidolra is szükségük van, szigorúan felügyelje az ammóniaszintet.
Probenecid
A Probenecid meggátolhatja a glicerin-fenilbutirát, köztük a PAGN anyagcseretermékeinek vese általi kiválasztását.
Fogamzóképes nőkek hatékony fogamzásgátlást kell alkalmazniuk (lásd SPC 4.6 pont).
A RAVICTI nem alkalmazható terhesség alatt és olyan fogamzóképes korú nők esetében, akik nem alkalmaznak fogamzásgátlást, kivéve, ha a nő klinikai állapota szükségessé teszi a glicerin-fenilbutiráttal történő kezelést, lásd SPC 4.6 pont.
Biztonsági, és termékpanasz jelentések
▼ Ez a gyógyszer fokozott felügyelet alatt áll, mely lehetővé teszi az új gyógyszerbiztonsági információk gyors azonosítását. Az egészségügyi szakembereket arra kérjük, hogy jelentsenek bármilyen feltételezett mellékhatást.A mellékhatás-bejelentő lapot és az ezzel kapcsolatos tájékoztatást itt találja: www.mhra.gov.uk/yellowcard. A mellékhatásokat e-mailben az Immedica felé is jelenteni kell: safety@immedica.com
Ha termékpanaszt szeretne jelenteni, azt a nemzeti előírások szerint elsősorban a helyi gyógyszertár felé kell jelenteni. Az Immedica Quality-vel is felveheti a kapcsolatot: complaints@immedica.com
Referencia:
1. RAVICTI European Assessment Report.
2. Summary of Product Characteristics RAVICTI.
3. Nagamani SC et al. Mol Genet Metab. 2015;116:29–34.

